Der Einsatz von
Gerinnungsfaktoren
Die Hämophilie wird mit Gerinnungsfaktoren behandelt, die entweder aus menschlichem Blutplasma gewonnen oder biotechnologisch hergestellt werden können.
Plasmatische Gerinnungsfaktoren
Früher konnten Faktorenkonzentrate nur aus menschlichem Blut hergestellt werden. Dafür wurden die jeweiligen Gerinnungsfaktoren in aufwändigen Prozessen aus dem Blutplasma von Blutspenden gewonnen. Solche auf natürlichem Wege gewonnenen Präparate bezeichnet man als plasmatische Gerinnungsfaktoren-Konzentrate. Bei Hämophilie A gibt es eine besondere Variante von Faktor VIII-Konzentraten, die gleichzeitig von-Willebrand-Faktor (vWF) enthalten. vWF ist zwar per se kein direkter Gerinnungsfaktor, spielt in der Blutgerinnung aber trotzdem eine wichtige Rolle. Zum Beispiel bindet er an den Faktor VIII und schützt ihn so vor einem vorzeitigen Abbau. Mehr zum von-Willebrand-Faktor finden Sie unter Netzwerk vWS.
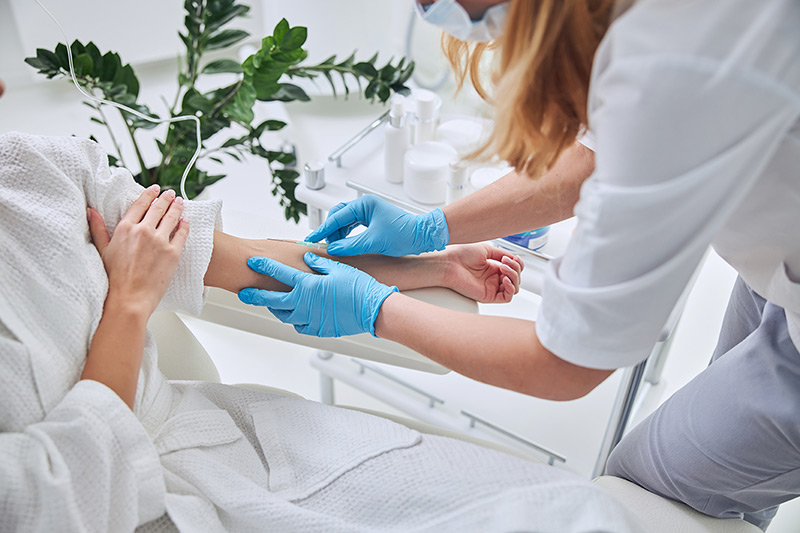
Gewinnung von plasmatischen Gerinnungsfaktoren
Plasmatische Gerinnungsfaktoren-Konzentrate werden aus menschlichem Spenderblut hergestellt.
Rekombinante Gerinnungsfaktoren
Seit geraumer Zeit ist es möglich, die Gerinnungsfaktoren auch biotechnologisch herzustellen. Die Produktion erfolgt dabei durch genetisch modifizierte Zellen, die in sogenannten Bioreaktoren gezüchtet werden. Solche künstlich erzeugten Präparate bezeichnet man als rekombinante Gerinnungsfaktoren-Konzentrate. Die künstlich hergestellten Gerinnungsfaktoren können auch so modifiziert werden, dass sie über eine verlängerte Halbwertszeit und damit eine längere Wirkdauer verfügen. Bei der prophylaktischen Therapie bedeutet dies, dass sie seltener gespritzt werden müssen. Rekombinante Gerinnungsfaktoren werden in sogenannten Bioreaktoren von entsprechend modifizierten Zellen hergestellt.
Formen der Therapie mit Gerinnungsfaktoren
Beim Ersatz von Gerinnungsfaktoren gibt es zwei Vorgehensweisen: Die Akuttherapie (auch "On-Demand-Therapie" genannt) und die prophylaktische (vorbeugende) Therapie. Die Akuttherapie kommt bei allen Schweregraden der Hämophilie zum Einsatz. Die prophylaktische Therapie ist vor allem dann notwendig, wenn häufiger Blutungen und insbesondere Gelenkblutungen auftreten. Dies betrifft insbesondere Patienten mit schwerer oder mittelschwerer Hämophilie.
Akuttherapie
Die Akuttherapie wird nur bei Bedarf angewendet. Sie kommt zum Einsatz, wenn bereits eine Blutung vorliegt und hat das Ziel, diese zu stoppen. Für viele Hämophilie-Patienten reicht eine solche Bedarfsbehandlung (On-Demand-Behandlung) aus. Die Ärzte gehen bei einer Faktoren-Restaktivität von mindestens fünf Prozent gegenüber dem Normalwert (>40 %) davon aus, dass kleinere Blutungen noch von selbst zum Stillstand kommen und dass keine nennenswerten Spontanblutungen auftreten. In leichteren Fällen und bei kleineren Blutungen kommt auch eine Akutbehandlung mit DDAVP (Desmopressin) in Frage.
Behandlung mit Gerinnungsfaktoren
Kleinere Wunden kommen bei Kindern häufiger vor. Damit bei Blutern daraus kein großes Problem wird, gibt es die Therapie mit Gerinnungsfaktoren.
Prophylaktische (vorbeugende) Therapie
Bei einer schweren oder mittelschweren Hämophilie sollte eine prophylaktische Therapie zum Einsatz kommen, um (Spontan-)Blutungen zu vermeiden. Unbehandelt treten letztere insbesondere bei einem Faktor-Talspiegel von unter drei Prozent auf. Wenn solche Spontanblutungen beispielsweise die Gelenke betreffen, können sie schwerwiegende Langzeitfolgen haben. In solchen schweren Fällen wird das Faktorenkonzentrat vorbeugend gespritzt. Dazu kann es notwendig sein, mehrmals pro Woche den fehlenden Gerinnungsfaktor zu ersetzen. Wie oft und in welcher Dosierung die prophylaktische Anwendung notwendig ist, hängt von vielen Umständen ab. Deshalb muss sich die Therapie an den Bedürfnissen des Patienten orientieren und individuell angepasst werden. Grundsätzlich gilt, dass Faktor VIII eine kürzere Halbwertszeit hat als Faktor IX. Deshalb müssen sich Hämophilie A-Patienten in der Regel häufiger spritzen (dreimal in der Woche oder alle zwei Tage) als Patienten mit Hämophilie B (in der Regel ein bis zweimal wöchentlich).
Die prophylaktische Behandlung
Ziel der prophylaktischen Therapie ist es, mit den Injektionen die Blutspiegel des fehlenden Faktors so anzuheben, dass die Gerinnungsfaktoren-Aktivität mindestens drei bis fünf Prozent des Normalwertes entspricht.
Vor Operationen sind deutlich höhere Blutspiegel notwendig. Spontanblutungen ohne erkennbare Ursachen betreffen bei Blutern häufig die Kniegelenke und Sprunggelenke und können langfristige Folgen haben. Aufgabe der Prophylaxe ist es, Blutungen zu vermeiden.
